Materi dan Klasifikasinya
Materi adalah segala sesuatu yang menempati ruang dan memiliki massa. Massa menunjukkan seberapa banyak materi dalam suatu obyek, sedangkan berat menunjukkan seberapa besar gaya pada obyek tersebut, yang mana obyek itu ditarik oleh gaya gravitasi.
Zat adalah bentuk materi yang memiliki komposisi tetap dan karakteristik khas. Contohnya air, ammonia, gula (sukrosa), emas, dan oksigen. Masing-masing zat berbeda dari satu sama lain dalam hal komposisi dan dapat diidentifikasi oleh tampilan, bau, rasa dan ciri lainnya.
Zat murni dapat berupa unsur atau senyawa. Unsur adalah zat yang tidak dapat dipisahkan lagi menjadi bagian yang lebih kecil dengan reaksi kimia. Hingga saat ini sudah ada 117 unsur yang telah diidentifikasi. Kebanyakan unsur berasal dari proses alam di bumi. Sebagian yang lain dibuat oleh ilmuwan melalui proses reaksi nuklir. Untuk memudahkan, ahli kimia menggunakan lambang-lambang dari satu atau dua huruf untuk mewakili unsur tersebut. Huruf pertama selalu huruf kapital, tetapi huruf berikutnya tidak. Contohnya Co adalah lambang unsur kobalt, sedangkan CO adalah rumus kimia molekul karbon monoksida. Lambang dari beberapa unsur diambil dari nama Latin—misal Au dari aurum (emas), Fe dari ferrum (besi), dan Na dari natrium (sodium/natrium)—sementara yang lainnya berasal dari nama Inggris mereka. Atom-atom kebanyakan unsur dapat berinteraksi satu sama lain untuk membentuk senyawa. Gas hidrogen misalnya, terbakar dalam gas oksigen untuk membentuk air. Air memiliki karakteristik yang berbeda dari bahan pembentuknya. Air terbuat dari 2 bagian hidrogen dan 1 bagian oksigen. Komposisi ini tidak berubah di manapun letak air tersebut, entah di danau, laut, kolam ikan, bahkan di planet Mars sekalipun. Hal ini menunjukkan bahwa air adalah senyawa yang tersusun dengan proporsi tiap bahan pembentuk yang tetap. Tidak seperti campuran, senyawa hanya dapat dipisahkan melalui reaksi kimia untuk kembali menjadi bahan awal pembentuknya. Pembentukan senyawa melibatkan perubahan kimia (reaksi kimia) karena karakteristik kimiawi zat awal turut berubah. Besi dan belerang, berkombinasi membentuk senyawa yang disebut sebagai ‘emas palsu’ karena tampilannya mirip sekali dengan emas asli. Dalam senyawa, unsur tak lagi memiliki sifat asalnya dan tidak dapat dipisahkan dengan pemisahan fisika. Dekomposisi emas palsu menjadi besi dan sulfur juga merupakan reaksi kimia.
Semua zat, setidaknya secara teori, dapat berada dalam kondisi padat, cair, gas (plasma, bentuk materi lainnya, semisal api akan dibahas tersendiri di tulisan lain). Gas berbeda dari cairan dan padatan berdasarkan jarak antar molekul. Dalam padatan, partikel tersusun berdekatan dan teratur, serta tidak bergerak dengan bebas. Partikel dalam cairan tersusun berdekatan namun tak serapat padatan, partikel masih dapat bergerak melewati satu sama lain. Dalam gas, partikel dipisahkan dengan jarak yang sangat jauh dibandingkan dengan ukuran molekul mereka. Tiga keadaan materi dapat berganti satu sama lain tanpa mengubah komposisi zat. Contoh, es yang dipanaskan akan berubah jadi cair. Suhu di mana transisi ini terjadi disebut titik lebur. Pemanasan lebih jauh akan mengubah cairan menjadi gas. Contoh, air dipanaskan hingga menguap. Di sisi lain, mendinginkan suatu gas akan menyebabkan ia mengembun menjadi cairan. Ketika cairan didinginkan, ia akan menjadi padatan.
Sumber gambar: Chang, 2010.
Campuran adalah kombinasi dua zat murni atau lebih di mana masing bahan-bahan masih memiliki sifat asalnya. Contohnya udara, minuman karbonasi, susu, semen. Campuran tidak memiliki komposisi yang konstan. Oleh karena itu, misal sampel udara yang diambil di kota yang berbeda akan memiliki perbedaan komposisi karena adanya perbedaan kadar polusi, letak ketinggian, dan lainnya.
Campuran dapat berupa campuran homogen atau heterogen. Gula yang dilarutkan dalam air akan menjadi campuran homogen dengan komposisi campuran yang sama. Namun jika pasir dicampur dengan air tidak akan tercampur seperti seperti gula yang larut, tapi akan terpisah kembali, campuran ini disebut campuran heterogen.
Sumber gambar: Jespersen et al, 2012.
Struktur Atom
Atom terdiri dari tiga partikel dasar, yaitu proton, elektron dan neutron. Proton dan neutron terdapat dalam inti atom sedangkan elektron berada dalam ruang sekitar inti atom.
Elektron
Sumber gambar: Jespersen et al, 2012.
Tahun 1897, J.J Thomson meneliti sinar katode dan dipastikan sinar katoda merupakan partikel bermuatan negatif. Partikel ini yang disebut elektron. Penyeldikan muatan elektron dilakukan oleh Robert A. Millikan pada tahun 1868-1955, dikenal dengan percobaan tetesan minyak. Berdasarkan percobaan itu, Millikan membuat kesimpulan bahwa muatan 1 elektron adalah -1,6 x 10-19 coulomb.
Proton
Sumber gambar: Jespersen et al, 2012.
Setelah pencetusan istilah sinar katoda, Eugene Goldstein mengisyaratkan adanya muatan positif dalam atom. Goldstein menggunakan tabung sinar katoda yang telah dilubangi. Sewaktu sinar katoda merambat menuju katoda, teramati adanya sinar yang bergerak berlawanan mendekati lubang pada plat katoda. Karena arahnya berlawanan, maka dapat disimpulkan sinar tersebut tersusun dari partikel bermuatan positif. Karena berasal dari anode maka disebut sinar anoda. Pada perkembangan berikutnya Ernest Rutherford membuktikan keberadaan partikel positif tersebut dan diberi nama proton. Eksperimen menentukan muatan proton tersebut dilakukan bersama Ernest Rutherford dan dua muridnya dengan menembakkan sinar alfa (muatan positif) pada lempeng emas tipis dan menyimpulkan bahwa muatan 1 proton adalah +1,6 x 10-19 coulomb.
Neutron
Penemuan neutron diawali ketika Rutherford berusaha menghitung jumlah muatan positif dala inti atom dan massa atom. Diharapkan massa muatan positif sama dengan massa atom mengingat massa elektron sangat kecil. Ternyata, massa proton hanya setengah dari massa atom H. Dengan demikian harus ada partikel tidak bermuatan yang memiliki massa hampir sama dengan massa proton.
James Chadwick berhasil membuktikan keberadaan neutron dengan menembakkan sinar alfa ke lempeng berilium. Penembakan itu menghasilkan radiasi tak bermuatan. Bukti radiasi tersebut ditunjukkan dengan berilium yang memancarkan partikel berdaya tembus tinggi yang tidak terpengaruh medan listrik dan medan magnet. Partikel itu diberi nama neutron. Massa neutron hampir sama dengan neutron yaitu 1,675 x 10-24 gram.
Nomor Atom dan Nomor Massa
Nomor atom merupakan jumlah proton dalam inti atom suatu unsur dengan lambang (Z). Atom-atom dari unsur yang berbeda memiliki jumlah proton yang berbeda, sedangkan atom dari unsur yang sama memiliki jumlah proton yang sama.
Nomor massa adalah total proton dan neutron dalam suatu inti atom dengan lambang (A). Tanda atom unsur sering ditulis dengan lambang (X). Penulisan nomor atom dan nomor massa ditulis dengan notasi sebagai berikut.
Contoh
Lambang unsur (X): Ca (kalsium)
Nomor atom (Z): 20
Nomor massa (A): 40
Dengan demikian maka partikel subatomik Ca dapat dituliskan sebagai berikut.
Proton (p) = Z = 20
Elektron (e) = p = 20
Neutron (n) = A-Z = 40-20 = 20
Isotop, Isobar, Isoton Isotop: atom-atom yang mempunyai nomor atom yang sama tetapi nomor massanya berbeda. Contoh:
Isobar: atom-atom yang mempunyai nomor massa sama tetapi nomor atomnya berbeda. Contoh:
Isoton: atom-atom yang mempunyai jumlah neutron sama tetapi nomor massa dan atomnya berbeda.
Massa Atom Relatif
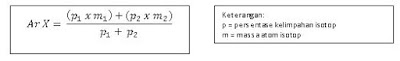
Massa atom relatif berguna dalam mengetahui sifat unsur atau senyawa. Massa atom relatif adalah bilangan yang menyatakan perbandingan massa atom rata-rata suatu unsur tersebut terhadap 1/12 kali massa satu atom karbon. Massa atom relatif diberi lambang Ar (btw tolong jangan samakan aku dengan si Argon, aku bukan dia dan aku gak suka dibanding-bandingin, makasih :p).
Untuk unsur yang memiliki lebih dari satu isotop, Ar merupakan nilai rata-rata dari tiap massa isotope dengan memperhitungkan kelimpahannya.
Tabel Massa dan Muatan Partikel Penyusun Atom
Sumber gambar: Jespersen et al, 2012.
Sumber:
BSNP. 2006. Kurikulum Tingkat Satuan Pendidikan Mata Pelajaran Kimia untuk SMA/MA. Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional.
Chang, Raymond. 2010. Chemistry, 10th edition. New York: The McGraw-Hills Companies, Inc.
Harnanto, Ari; Ruminten. 2009. Kimia 1 untuk SMA/MA Kelas X BSE. Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional.
Jespersen, N.D. et al. 2012. Chemistry: The Molecular Nature of Matter 6th Edition. New Jersey: John Wiley & Sons, Inc.
Setyawati, Arifatun Anifah. 2009. Kimia: Mengkaji Fenomena Alam untuk Kelas X SMA/MA BSE. Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional.











Comments
Post a Comment